Kit Lightmix … chỉ cần tờ khai hải quan
Ngày 26/3/2021, trong vai khách hàng, PV báo Kinh tế & Đô thị được nhân viên của Roche Việt Nam tư vấn rằng, dòng kit có tên thương mại Lightmix là kit của Roche, và đang được sử dụng tại nhiều nơi ở Việt Nam: “Kit này đã được WHO và Bộ Y tế cho xài ở Việt Nam, theo khuyến cáo của nhiều công văn. Và vì kit Lightmix là kit RUO nên khi nhập vào Việt Nam không cần có giấy phép nhập khẩu, mà chỉ cần có tờ khai hải quan là được”, nhân viên của Roche tư vấn.
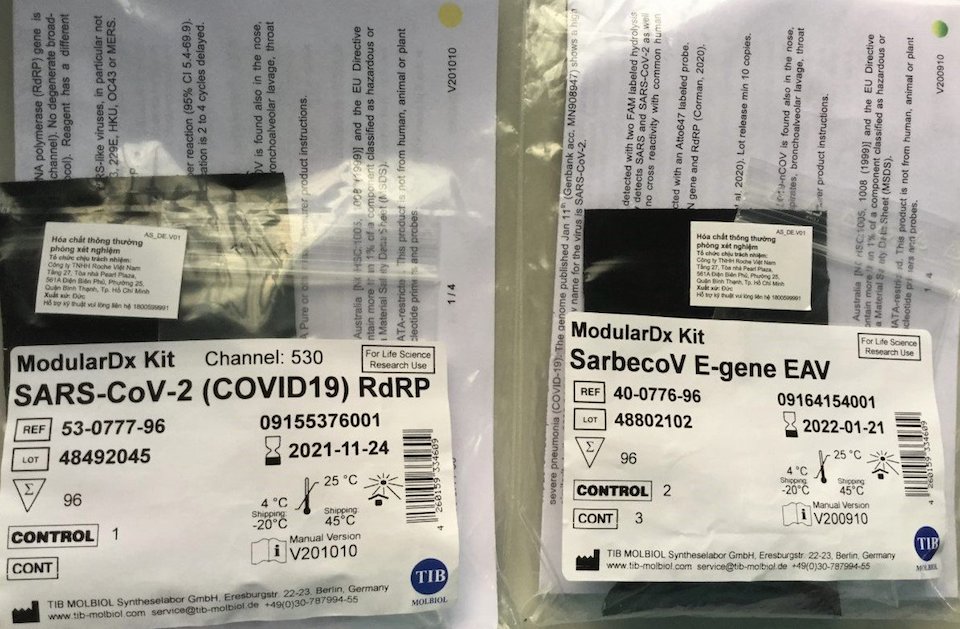
Hình ảnh thực tế sản phẩm Lightmix
Tuy nhiên, theo tìm hiểu của PV, kit Lightmi là bộ kit được sản xuất bởi Tib Mobiol – Đức và Roche chỉ là nhà phân phối, hay nói cách khách là Roche lấy kit do Tib Mobiol về bán chứ sản phẩm này không phải là kit do Roche sản xuất. Với những thông tin trái ngược trên, Roche Việt Nam đã không trung thực trong bán hàng.
Tại Việt Nam, tất cả các kit xét nghiệm SARS-CoV-2 đều phải được Bộ Y tế Việt Nam cấp phép, hoặc được WHO và CDC Hoa Kỳ cấp phép thì mới được sử dụng. Theo hướng dẫn mới nhất trong quyết định số 4042/QĐ-BYT, tại trang 4 có ghi rõ “Bất cứ loại kỹ thuật xét nghiệm nào cũng phải được đánh giá chất lượng và hiệu quả trước khi sử dụng”. Vậy kit lightmix đã được cấp phép lưu hành và thử nghiệm khi nào, kết quả ra sao?.
Bởi trong Công văn số 4043/BYT-TB-CT (ngày 29/7/2020) gửi Sở Y tế các tỉnh, thành phố trực thuộc trung ương; các Bệnh viện, Viện nghiên cứu trực thuộc Bộ Y tế và y tế các Bộ, ngành về danh sách các sinh phẩm/trang thiết bị y tế chuẩn đoán in vitro xét nghiệm vi rút Corona (SARS-CoV-2) đã được cấp số đăng ký, cấp giấy phép nhập khẩu, Bộ Y tế nêu rất rõ chỉ có 12 kit phát hiện SARS-CoV-2 nhập khẩu được cấp phép. Và trong đó không có kit nào có tên thương mại là Lightmix, cũng như không có hãng sản xuất nào là Tib Mobiol. Mà cụ thể ở mục 2 (II) lại là thông tin như sau: “trang thiết bị chẩn đoán in vitro xét nghiệm virut Corona dung cho máy PCR – về chủng loại : cobas® …Hãng sản xuất/ nước sản xuất là Roche Molecular Systems INS/Mỹ. Sô giấy phép là 15037/NK/BYT-TB-CT ngày 30/3/2020; Công ty nhập khẩu là Roche Việt Nam…
Vậy, kit Lightmix xét nghiệm Covid19 mà Roche Việt Nam bán tại Việt Nam thời gian qua là gì?
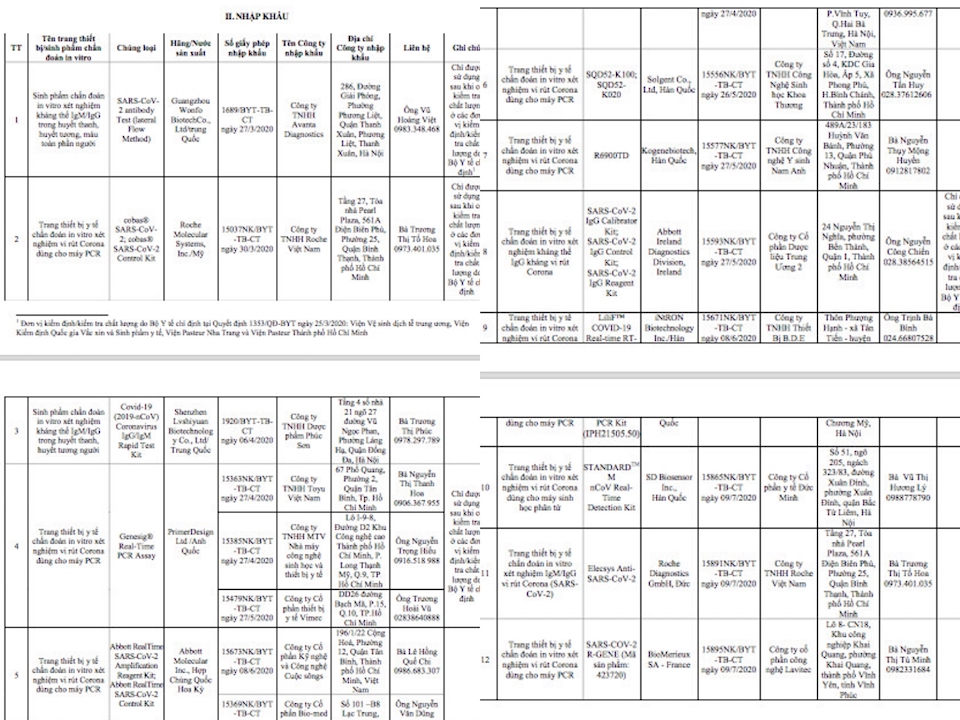
Danh sách 12 kit phát hiện SARS-CoV-2 nhập khẩu được Bộ Y tế cấp phép, không có kit Lightmix
Chưa hết, trên tờ giới thiệu và hướng dẫn sử dụng cũng như trên bao bì sản phẩm kit Lightmix, chỉ thấy dòng chữ “Research use”, nghĩa là “dùng cho nghiên cứu” chứ không hề thấy có dòng chữ “For in vitro diagnostic” (IVD), nghĩa là “dùng cho chẩn đoán”.
Vậy khi mà nhà sản xuất là Tib Mobiol xác nhận bộ kit Lightmix chỉ “dùng cho nghiên cứu” chứ không phải “dùng cho chẩn đoán” thì việc Roche Việt Nam nhập về, bán ra là sao?. Chưa kể là bộ kit Lightmix này vẫn chưa thấy Bộ Y tế Việt Nam, WHO hay FDA Hoa Kỳ cấp phép.
Viện Pasteur TP Hồ Chí Minh có khuất tất?
Theo tìm hiểu của PV, 1 bộ kit phát hiện SARS-CoV-2 bằng kỹ thuật real-time RT-PCR sẽ bao gồm: Bộ mồi và mẫu dò đặc trưng cho SARS-CoV-2; Bộ mix (sinh phẩm) để thực hiện real-time RT-PCR. Và khi mua kit về thì không cần mua thêm gì khác là có thể thực hiện xét nghiệm SARS-CoV-2.
Còn bộ kit Lightmix chỉ có “Bộ mồi và mẫu dò đặc trưng cho SARS-CoV-2”, khi mua về phải mua thêm “Bộ mix (sinh phẩm) để thực hiện real-time RT-PCR” (là 1 thành phần chính) mới thực hiện được xét nghiệm SARS-CoV-2.
Như vậy, đây không thể gọi là bộ kit mà chỉ là 1 thành phần của bộ kit. Bộ Lightmix này "kit cũng không ra kit, quy trình cũng không ra quy trình". Việc cấp phép chỉ có thể cho bộ kit hoặc cho 1 quy trình (như WHO khuyến cáo cho quy trình của Tib Mobiol) chứ chắc chắn không thể cho 1 cái nửa vời như bộ Lightmix này. Và đây cũng chính là lý do khiến Bộ Y tế, WHO cũng như FDA Hoa Kỳ không cấp phép cho bộ Lightmix này.
Sự việc sẽ không có gì để nói nếu bộ Lightmix này được giới thiệu và sử dụng đúng chức năng của nó, tức là nó không phải của Roche mà Roche chỉ là nhà phân phối, và Lightmix không được sử dụng cho chẩn đoán mà chỉ dùng cho nghiên cứu.
Như vậy, điều lo ngại rằng nếu đem vào sử dụng bộ Lightmix này cho xét nghiệm SARS-CoV-2 thì kết quả ra sao?.
Thế nhưng, Viện Pasteur TP Hồ Chí Minh lại là nơi ký hợp đồng mua kit xét nghiệm của Tib Mobiol Sản xuất và Roche lại ghi là hãng sở hữu. Trong khi theo nguyên bản của Tib Mobiol ghi là “Distributed by Roche” (tức là được phân phối).
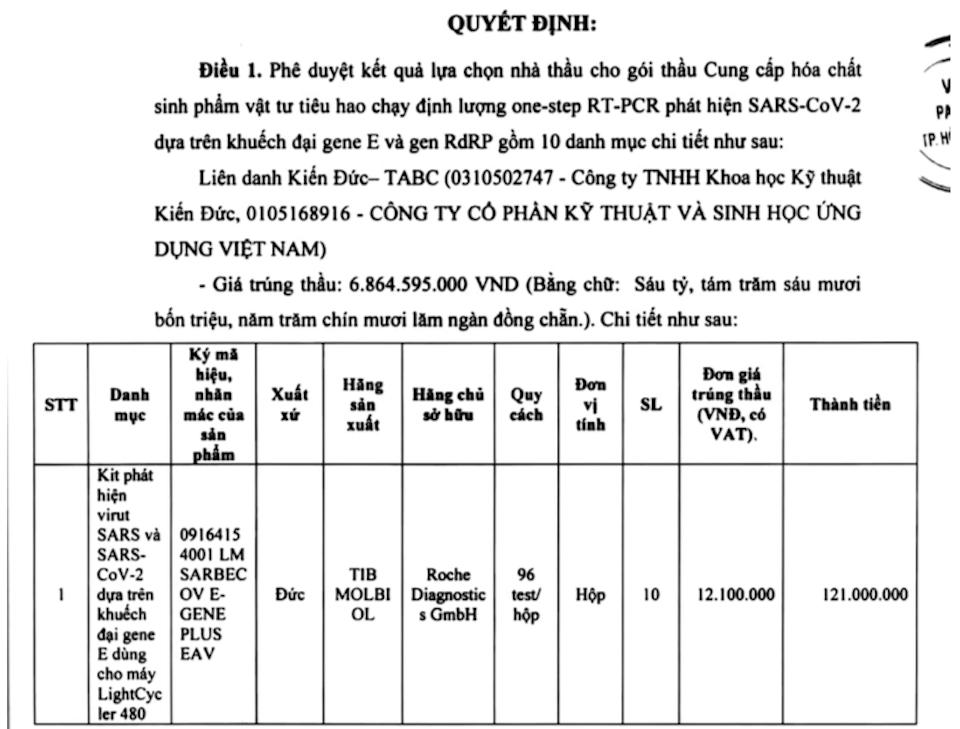
Trong gói thầu ngày 29/12/2020 cho thấy, Viện Pasteur TP Hồ Chí Minh có mua bộ Lightmix có gene E giá 12.1tr/96 test
Chưa hết, theo hướng dẫn của WHO, trước đây để phát hiện SARS-CoV-2 thì có gene E và gene RdRp, từ 08/2020 WHO đã loại RdRp ra khỏi quy trình. Tương tự, vào 21/09/2020, Bộ Y tế Việt Nam cũng đã ban hành quyết định số 4042/QĐ-BYT hướng dẫn phát hiện SARS-CoV-2 theo quy trình WHO cũng không có gene RdRp (phụ lục 2, trang 18).
Song, trong gói thầu của Viện Pasteur ký hợp đồng vào 29/12/2020 cho thấy, đơn vị này vẫn mua bộ Lightmix có gene RdRp (ngoài bộ Lightmix có gene E là bắt buộc); Bộ Lightmix có gene E giá 12.1tr/96 test; Bộ E Assay của IDT có gene E giá 21tr/1000 test (cái này có trong quy trình WHO khuyến cáo).
Như vậy, tại sao 1 bộ kit mà chính nhà sản xuất hướng dẫn dùng cho “nghiên cứu” chứ không phải cho “chẩn đón” và không có giấy phép của bất kỳ cơ quan chức năng nào mà được 1 đơn vị đầu ngành như Viện Pasteur Hồ Chí Minh sử dụng?. Thứ hai, tại sao 1 thành phần có trong quy trình WHO khuyến cáo (bộ E Assay của IDT) với giá rất rẻ (21tr/1000 test) không được mua hoàn toàn mà phải chen bộ Light không được cấp phép với giá cao hơn ~5 lần vào (12.1tr/96 test)?. hứ ba, tại sao 1 vùng gene (RdRp) đã bị WHO loại bỏ mà vẫn mua dùng? Đây chỉ đơn thuần là sự lãng phí hay còn có khuất tất nào khác?
Giải đáp những nghi vấn nói trên, ngày 1/4, Dược sĩ Hoàng Thuỳ Linh - Phó Giám đốc Trung tâm Kiểm định thiết bị y tế (Viện Pasteur TP Hồ Chí Minh) đã có văn bản phản hồi đến báo Kinh tế & Đô thị, liên quan đến nội dung phản hồi này, Tieudung.vn sẽ tiếp tục phân tích ở bài sau.
|
Roche Việt Nam nhập nhằng bán sản phẩm xét nghiệm SAR-CoV-2 Thời điểm tháng 4/2020, Tieudung.vn đã thực hiện bài viết “Roche Việt Nam bán máy xét nghiệm Covid-19 khi còn đang… thử nghiệm?” và bài viết “Tiếp vụ “Roche Việt Nam bán máy xét nghiệm Covid-19 khi còn đang … thử nghiệm?”: “Cú áp phe” lịch sử!”. Tưởng rằng sau những phản ánh nói trên, hiện nay, Công ty TNHH Roche Việt Nam (Roche Việt Nam) sẽ không còn nhập nhằng trong việc bán sản phẩm của mình. Tuy nhiên, gần đây, ghi nhận của PV báo Kinh tế & Đô thị lại cho thấy, Roche Việt Nam vẫn đang “bổn cũ soạn lại”, bán sản phẩm không phải là của mình nhưng lợi dụng uy tín, thương hiệu của Roche để nhập nhằng đó là sản phẩm của Roche, và điều đáng nói hơn là sản phẩm này chưa được Bộ Y tế Việt Nam cấp phép. |