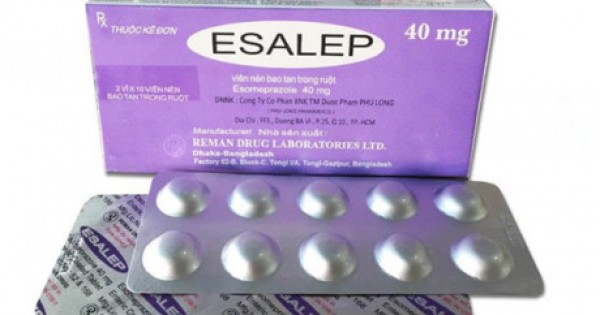
Theo tìm hiểu được biết, thuốc Esalep được sử dụng để điều trị loét dạ dày tá tràng và viêm thực quản ăn mòn, trào ngược dạ dày và hội chứng Zollinger-Ellison. Thuốc Esalep cũng được sử dụng với các loại thuốc kháng sinh (ví dụ, amoxicillin, clarithromycin) để điều trị loét được gây ra bởi các vi khuẩn H. pylori...Tuy nhiên sau một thời gian kiểm tra, kiểm nghiệm, Cục Quản lý dược nhận thấy chất lượng thuốc này không đạt chuẩn và quyết định rút giấy phép thu hồi trên toàn quốc.
Cụ thể, Cục Quản lý dược (Bộ Y tế) đã có quyết định rút hồ sơ đăng ký lưu hành thuốc Esalep điều trị loét dạ dày, tá tràng ra khỏi danh mục các loại thuốc được đăng ký tại Việt Nam và đình chỉ lưu hành. Quyết định trên được Cục Quản lý dược thông báo theo công văn số 163/QĐ.
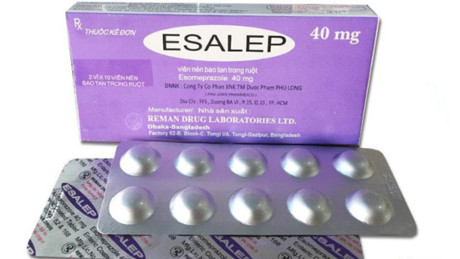 |
| Thuốc Esalep điều trị viêm loét dạ dày bị đình chỉ lưu hành. |
Theo đó, tại quyết định này, thuốc Esalep, SĐK: VN-12168- 11 do Công ty Reman Drug Laboratories Ltd sản xuất, Công ty Aum Impec (PVT) Ltd đứng tên đăng ký bị Cục Quản lý Dược rút số đăng ký vì không đạt tiêu chuẩn chất lượng theo quy định về quản lý chất lượng thuốc của Bộ Y tế, đồng thời thuốc được sản xuất không đúng với hồ sơ đăng ký thuốc đã được Bộ Y tế phê duyệt.
Ngoài ra, trong đợt này, Cục Quản lý Dược cũng đồng thời đình chỉ lưu hành trên toàn quốc và thu hồi toàn bộ các lô thuốc Esalep, SĐK- 12168-11. Các cơ sở nhập khẩu và ủy thác nhập khẩu nêu trên thực hiện việc thu hồi, báo cáo kết quả thu hồi thuốc theo quy định tại Thông tư số 09/2010-TT-BYT của Bộ Y tế về hướng dẫn quản lý chất lượng thuốc.
Để đảm báo an toàn cho người sử dụng, Cục Quản lý Dược cũng ngừng tiếp nhận hồ sơ mới đăng ký thuốc và ngừng cấp số lưu hành thuốc đối với các hồ sơ đã nộp do Công ty Reman Drug Laboratories Ltd sản xuất, Công ty Aum Impec (PVT) Ltd sản xuất, đứng tên đăng ký trong thời gian 24 tháng.
Cục Quản lý dược cũng ngừng tiếp nhận, xem xét hồ sơ nhập khẩu đối với các thuốc do Công ty Aum Impec (PVT) Ltd sản xuất, cung cấp vào Việt Nam và các thuốc do Công ty Reman Drug Laboratories Ltd sản xuất trong thời gian 24 tháng.
Liên quan tới chất lượng thuốc, mới đây Cục Quản lý dược cũng đã liệt danh sách các hồ sơ để nghị công bố cơ sở sản xuất đạt tiêu chuẩn PIC/S-GMP VÀ EU-GMP không đạt chuẩn. Theo đó đã có 8 đơn vị liệt vào danh mục trên. Quyết định này được Cục Quản lý dược (Bộ Y tế) ban hành theo công văn số 5843 /QLD-CL ngày 27/04/2017.
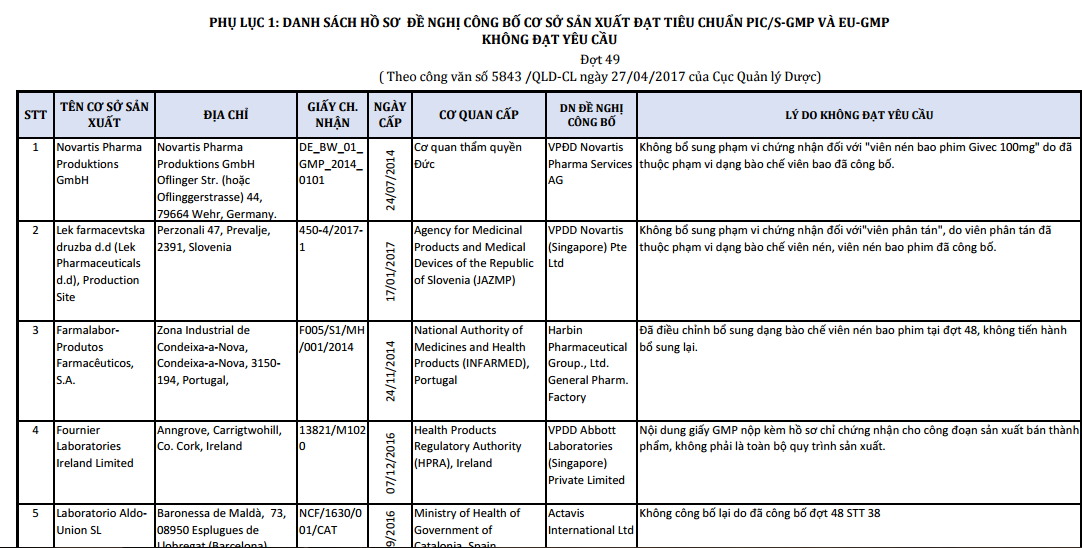 |
| Danh sách các cơ sở sản xuất thuốc không đạt chuẩn do Cục Quản lý dược công bố. |